188金宝慱亚洲体育APP下载188金宝搏下载手机版SignaGen Laboratories(SignaGen)是一家小型企业,专注于为生物医学研究社区开发和制造基因传递工具。基于我们独特的技术平台(正在申请专利,美国PTO#61135606和072308),SignaGen成功开发了三类DNA/RNA转染试剂,经验证,这些试剂可以轻松击败领先产品,具有极高的效率和低细胞毒性。更重要的是,我们以合理的价格提供这些转染试剂。
1.生物可降解聚合物(BDP)合成:
该BDP技术是我们的待处理(美国PTO#61135606和072308)的适当技术,其使我们能够合成可生物降解的聚阳离子聚合物。与其他可用阳离子聚合物如聚(L-赖氨酸)和聚(乙基亚胺)和阳离子脂质体不同,这种新的聚合物具有独特的骨架,其在哺乳动物细胞内的DNA / RNA卸载DNA / RNA之后可以降解(图1),导致细胞毒性极低。此外,这种新的聚合物符合具有优异的核酸结合亲和力和高缓冲能力,满足良好基因载体的基本设计标准。体外DNA转染实验表明,这种新的可生物降解的聚合物比聚(乙基亚胺)递送到HEK293T细胞中的聚(乙基亚胺)的效率更高2至10倍。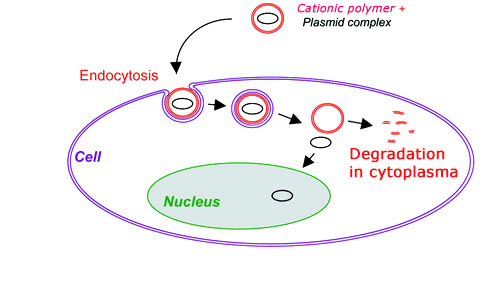
图1.显示DNA转染与可生物降解的聚合物的例证
2.病毒蛋白模拟(VIP)技术:
基因治疗是通过基因治疗药物的传递和表达来治疗人类遗传性和后天性疾病的先进技术。使用安全、高效、可控的基因载体是临床基因治疗成功的先决条件之一。虽然病毒载体在基因传递方面非常有效,但它们潜在的安全性和免疫原性问题增加了它们在临床应用中的风险。作为病毒载体的替代品,我们开发了一种独特的VIPs技术来模拟病毒核靶向肽序列。基于该VIPs平台,创建、合成和筛选了一系列模拟病毒(如慢病毒)核靶向肽序列。经证实,与脂质体DNA转染试剂结合,一系列模拟肽能够穿透细胞核孔,从而将DNA/RNA直接传递到细胞核(图2)。初步结果表明,几种模拟肽可以显著提高基于脂质体的基因在多种哺乳动物细胞上的传递效率,最高可达100倍。有趣的是,在难以转染的非分裂细胞上观察到协同效应,为难以转染的细胞提供了潜在的非病毒核酸载体。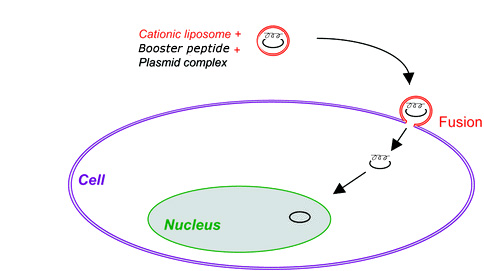
图2. 显示VIP模拟肽与脂质体转染试剂协同效应的图示
3.刮除细胞转染(SCT)技术:
细胞膜结构是脂质双层结构。脂类是两亲性的,因为它们有亲水性的极性头指向外面,疏水性部分形成核心。然而,细胞膜表面不均匀(图3-I)。许多外周膜分子包括糖脂、糖蛋白、糖脂中的碳水化合物和跨膜蛋白、离子通道也是膜的组成部分。此外,大多数细胞被其他几种类型的蛋白质修饰,这些蛋白质可以与其他细胞或细胞外基质结合。它们被称为细胞粘附分子(CAM)。所有这些外周膜分子被称为细胞的“毛发”(图3-I),阻碍转染复合物(图3-II和III)进入和穿透细胞,影响转染复合物的内吞作用。这就是为什么常规转染程序通常会导致较低的转染效率,尤其是在难以转染的细胞上。为了绕过细胞毛发的屏障,防止转染复合物的内吞作用,我们开发了具有专有转染协议的独特转染试剂。通过我们的专有转染程序“刮毛细胞转染(SCT)”,在进行转染之前,细胞的毛发被暂时刮毛,然后再重新电镀刮毛细胞(图3-IV&V)。SCT技术使转染复合物能够更容易、更有效地穿过和穿透细胞膜,从而使效率提高3~15倍(图3-V&VI)。SCT技术对于转染难以转染的细胞非常有用。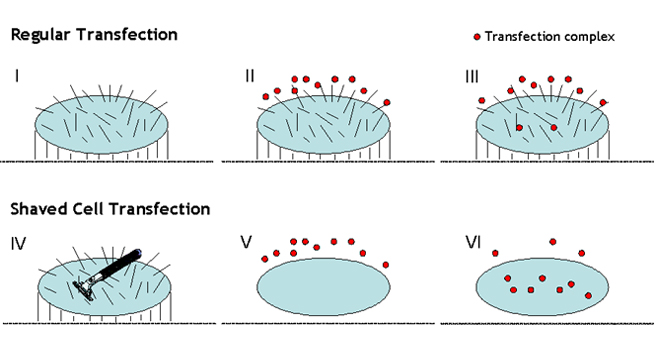
图3. 展示刮除细胞转染技术如何工作的插图
4.转染介导的细胞毒性去除(TMCR)技术:
研究人员在DNA/siRNA转染操作中经常遇到以下难题:高效的转染试剂通常具有很强的细胞毒性。有时毒性很强,转染后大量细胞被杀死。因此,研究人员不得不牺牲相对健康细胞的转染效率。我们可以通过去除转染介导的细胞毒性,提供一种在保持良好细胞活力的同时实现最大转染效率的解决方案。经过多年的研究,我们发现粘附在细胞表面的转染复合物导致细胞毒性(图4,上图)。由于转染复合物的性质,仅在转染后改变培养基是不可能将复合物洗掉的。我们开发了一种独特的产品,将几种化学物质混合制成鸡尾酒(正在申请专利,美国PTO#62375686),经确认可在室温下培养5分钟,有效去除与细胞表面结合的所有转染复合物(图4,下面板),从而去除转染介导的细胞毒性。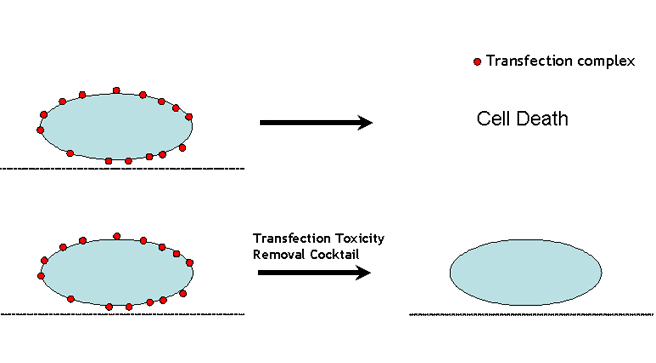
图4. 显示转染介导的细胞毒性去除(TMCR)技术如何工作的图示
5.pH依赖性构象变化(PDCC)技术可有效传递siRNA:
虽然脂质体或聚合物试剂通常具有非常好的DNA递送功效,但它们未能将siRNA有效地驱动到哺乳动物细胞中。脂质体或聚合物基SiRNA转染试剂的性能差可以与siRNA阴离子区段的长度连接,其太短,不能与阳离子脂质或聚阳离子聚合物保持静电内核。因此,在触摸多阴离子细胞表面时,siRNA脂肪量或多种易于破裂。我们用特异性疏水基团修饰脂质体和聚合物,其在生理pH条件下赋予pH依赖性构象变化(PDCC)并大大稳定siRNA脂醇或多重。由PDCC技术产生的同样重要的性质是通过添加特异性疏水基团,可以控制siRNA脂肪量或多分发纳米颗粒,导致更好的siRNA转染效率。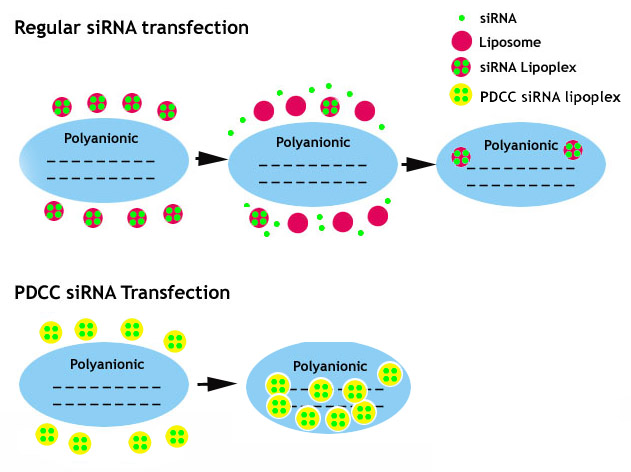
图5. 显示pH依赖性构象变化(PDCC)技术如何工作的图示
6. AD.MAX™技术用于最大腺病毒生产:
Ad.Max™技术是由转基因病毒包装细胞,HEK293细胞和腺病毒梭载体或腺病毒基因组开发的,用于最大的腺病毒生产。这种专有技术的核心位于基因工程的HEK293中,其中腺病毒复制保持完整,而在腺病毒包装过程中的病毒蛋白表达被显着抑制。结合腺病毒基因组中的反式元件,该腺病毒基因组识别HEK293细胞的抑制盒,AD.MAX™系统允许在病毒包装期间具有最小蛋白质表达的最大腺病毒产生。该系统对于包装腺病毒载体具有毒性基因(GOI)的毒性基因非常有用,否则将在腺病毒复制和生产期间杀死HEK293(图6),导致腺病毒产量急剧降低。AD.MAX™技术最终允许研究人员构建对腺病毒的所有基因(<7.5 kB)。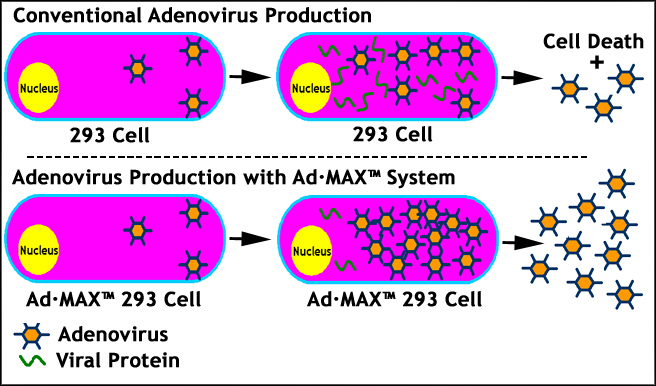
图6. 显示Ad.MAX如何工作的插图™ 技术工程
7.以超高滴度生产超传染性rAAV颗粒的多种方法:
与腺病毒不同,通过常规rav生产程序实现高产率的高产率较难。通过采用以下多策略,我们已经设法在超高滴度(最多1E + 15GC)的超高滴度(最多1E + 15GC)生产超级传染性(比常规RAAV)rAAV颗粒。
-AAV·HT™ 包装单元:我们筛选了不同类型的HEK293细胞,并培育出一株高产菌株——AAV·HT™ 根据我们的验证数据,包装单元产生的rAAV颗粒约为常规HEK293的10倍。
-修改rAAV cis向量:客户可以选择带有转基因下游截断的WPRE盒的rAAV-cis载体。在rAAV-cis载体中加入WPRE盒可以产生比不含WPRE的rAAV-cis载体多约8倍的rAAV颗粒。
- 修改rav capsid:rAAV衣壳在几个特定位点的突变显著(~30倍)体外&体内)提高rAAV转导效率。客户可以选择使用突变衣壳包装rAAV,以产生更具传染性的rAAV载体。
-成套双绞线AAV(dsAAV):双链AAV(dsAAV)也被称为自互补AAV(scAAV),被证实在这两种病毒中的转导效率高达50倍在里面体外培养和在里面活泼地. 定制服务可用于生成感兴趣的基因并将其打包到scAAV载体*。
- 先进的双CSCL超离心协议:高级方案的主要特点是在冷冻/解冻循环和预沉淀步骤后,在装载至超速离心之前,使用特殊配方的清洁剂进行处理。高级方案以高产量生产超纯化(临床试验级)和超传染性rAAV载体。看见图8有关详细信息。与常规协议的差异是粉红色的。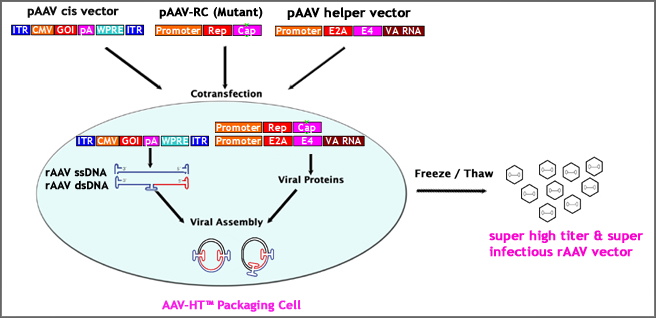
图7。在超高滴度下生产超传染raav粒子的多种方法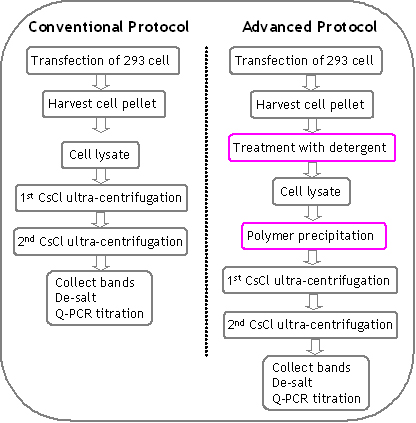
图8。高级协议和常规协议的概述和比较。高级协议中的差异正在用粉红色框起来。
8.兰提马克斯™ 最大产量的慢病毒包装系统:
慢病毒载体与慢病毒包装混合物共转染后,包装细胞内会产生大量的双链RNA(dsRNA)。dsRNA在细胞质中的积累将激活干扰素诱导的抗病毒防御途径。特别是与dsRNA结合后,干扰素诱导蛋白激酶(PKR)被激活。活化的PKR使真核生物起始因子-2α(eIF-2α)磷酸化,导致蛋白质合成起始受阻。这导致病毒RNA包装和翻译受到抑制,从而影响慢病毒特异性蛋白质的稳定性和加工(图9上图)。PKR抑制剂被证实能显著提高慢病毒滴度。
基于这一原理,我们成功地开发了LentiMAX™ 慢病毒包装系统,包括靶向U6启动子下PKR特异性变体的shRNA构建体。通过在慢病毒包装过程中引入PKR shRNA抑制PKR,我们从包装细胞上清液中获得了高达10^7 TU/mL的慢病毒,比传统包装方法高10倍(图9下图)。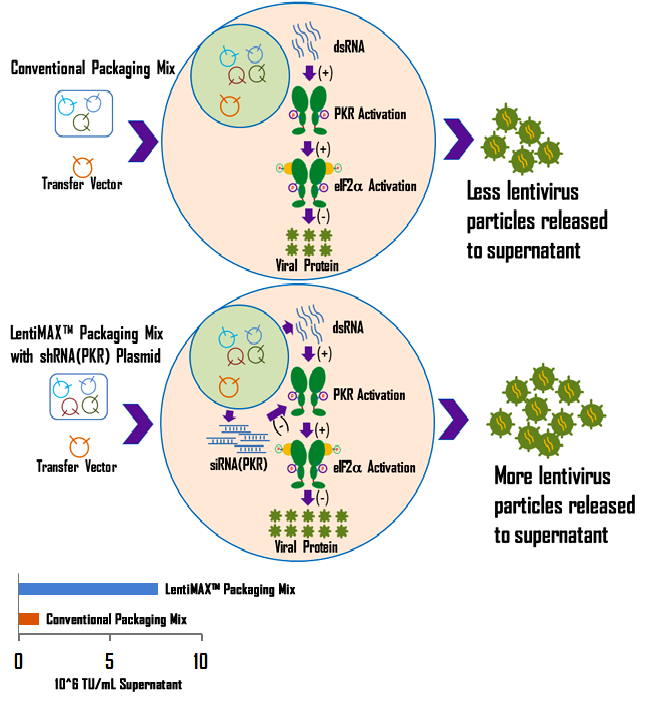
图9。一个演示如何使用LentiMAX的插图™ 包装系统工作。
*某些条款可能适用于定制scAAV生产和包装服务。
