AAV简介
腺相关病毒(AAV)是一种感染人类和一些其他灵长类动物的小病毒。AAV属于依赖属的属,反过来属于Parvoviridae的家族。病毒是一种小(20nm)复制缺陷的不合化病毒。目前未知AAV不会引起疾病,因此病毒会导致非常轻微的免疫应答。野生型AAV可以感染分裂和非分裂细胞,并且可以将其基因组掺入宿主细胞的内容。这些特征使AAV成为创建基因治疗的病毒载体的非常有吸引力的候选者,以及用于产生中源性人类疾病模型的生物载体。
AAV结构:
-AAV基因组、转录组和蛋白质组
AAV基因组由单链脱氧核糖核酸(ssDNA)构成,其长度约为4.7千碱基,可以是正的,也可以是负的。基因组包括DNA链两端的反向末端重复序列(ITRs)和两个开放阅读框(ORF):rep和cap。前者由编码AAV生命周期所需Rep蛋白的四个重叠基因组成,后者包含衣壳蛋白的重叠核苷酸序列:VP1、VP2和VP3,它们相互作用形成二十面体对称的衣壳(图1)。
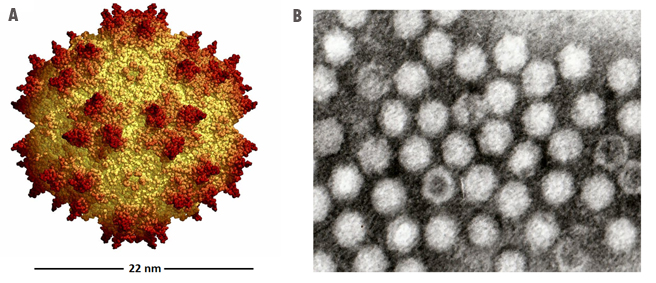
图1。腺相关病毒(AAV)结构和基因组图谱。A:模拟AAV大小和三维结构的卡通;B:一张显示纯化AAV载体的电子显微镜照片。
-ITR序列
反向末端重复序列(ITR)包括1个每个45个核苷酸。它们之所以这样命名是因为它们的对称性,这被证明是AAV基因组高效增殖所必需的。这些序列的另一个特性是它们能够形成发夹,这有助于所谓的自启动,允许第二条DNA链的非primase独立合成。研究还表明,ITR对于将AAV DNA整合到宿主细胞基因组(人类第19条染色体)和从中拯救以及AAV DNA的有效包封以及产生完全组装、抗脱氧核糖核酸酶的AAV颗粒(图2)都是必需的。关于基因治疗,ITRs似乎是治疗基因旁边的cis中唯一需要的序列:结构(cap)和包装(rep)基因可以反式传递。基于这一假设,建立了许多有效生产含有报告基因或治疗基因的重组AAV(rAAV)载体的方法。然而,也有报道称,ITR并不是cis中有效复制和封装所需的唯一元素。一些研究小组已经在Rep基因的编码序列中确定了一个指定为顺式作用Rep依赖元件(CARE)的序列。当cis中存在时,注意增加复制和包埋。
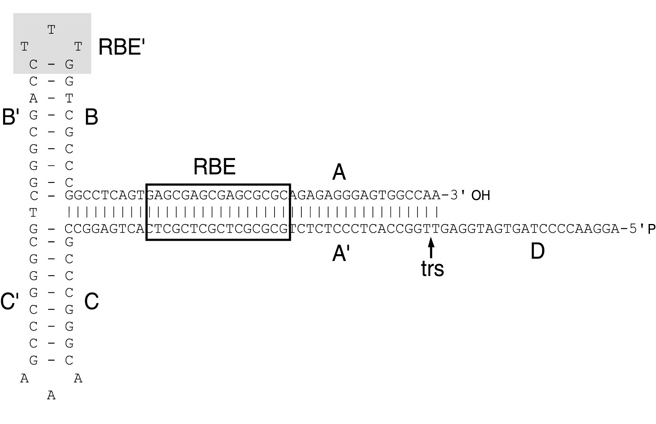
图2。AAV2 ITR的二级结构。AAV2 ITR作为复制的起源,由两个臂回文组(B-B'和C-C')组成,嵌入一个较大的茎回文组(a-a')。ITR可以获得两种配置(触发器和触发器)。触发器(如图所示)和触发器配置分别具有最靠近3'端的B-B'和C-C'回文。D序列在基因组的每一端只存在一次,因此保持单链。盒基序对应于AAV Rep78和Rep68蛋白质结合的Rep结合元件(RBE)。RBE由一个四核苷酸重复序列组成,共有序列为5'-GNGC-3'。Rep78和Rep68的ATP依赖性DNA解旋酶活性重塑了A-A'区域,产生了一个以单链形式位于末端解析位点(trs)顶端的茎环。在这种结构中,Rep78和Rep68的链和位点特异性内切酶催化结构域在trs处引入缺口。T形结构顶端的阴影核苷酸对应于另一个RBE(RBE'),它稳定两个最大的Rep蛋白和ITR之间的结合。
-Rep基因和Rep蛋白
在基因组的“左侧”上,有两个称为P5和P19的启动子,可以产生不同长度的两个重叠的信使核糖核酸(MRNA)。这些中的每一个都包含一个内含子,可以是拼接出的。鉴于这些可能性,可以合成四种各种MRNA,并因此合成具有重叠序列的四种各种REP蛋白。他们的名字描绘了千克(KDA):REP78,REP68,REP52和REP40中的尺寸。Rep78和68可以特异性地将由ITR形成的发夹在自引导行为中形成的发夹,并在发夹中指定的终端分辨率部位切割。对于AAV基因组的AAVS1特异性集成,它们也被证明是必要的。显示所有四种Rep蛋白结合ATP并具有螺旋酶活性。还表明它们上调了来自P40启动子的转录(下文),但下调P5和P19启动子(图3)。
-Cap基因与VP蛋白
正感知AAV基因组的右侧编码三个衣壳蛋白的重叠序列,VP1, VP2和VP3,它们从一个启动子开始,指定为p40。这些蛋白质的分子量分别为87、72和62千道顿。它们都是从一个信使rna翻译而来的。这个mRNA合成后,可以用两种不同的方式进行剪接:一个较长的或较短的内含子可以被切除,从而形成两个mRNA池:一个2.3 kb长的mRNA池和一个2.6 kb长的mRNA池。通常,特别是在腺病毒存在时,较长的内含子是首选,因此2.3 kb长的mRNA代表了所谓的“大剪接”。在这种形式下,VP1蛋白合成开始的第一个AUG密码子被切断,导致VP1蛋白合成的总体水平降低。保留在主剪接中的第一个AUG密码子是VP3蛋白的起始密码子。然而,在同一个开放阅读框中,该密码子的上游存在一个ACG序列(编码苏氨酸),该序列被一个最佳Kozak上下文包围。这使得VP2蛋白的合成水平较低,而VP2实际上是带有额外N末端残基的VP3蛋白,VP1也是如此。
因为更大的基因内区是首选的拼接,由于主要的拼接ACG密码子翻译起始信号微弱得多的比AAV对1:1:20结构体内蛋白质合成,这是一样的成熟的病毒粒子。VP1蛋白N端独特的片段具有磷脂酶A2 (PLA2)活性,这可能是AAV粒子从晚期核内体释放所必需的。据报道,VP2和VP3对正确的病毒粒子组装至关重要。然而,最近,Warrington等人发现VP2对于完整的病毒粒子形成和有效的感染是不必要的,并且VP2可以容忍其N端大量插入,而VP1则不能,这可能是因为PLA2结构域的存在。AAV衣壳由60个衣壳蛋白亚基VP1、VP2和VP3组成,按照1:1:10的比例排列成二十面体对称,估计大小为3900 KiloDaltons(图3)。
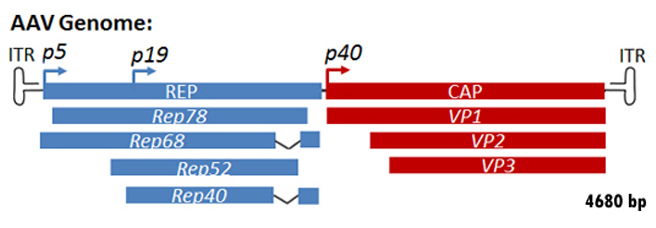
图3。这幅图显示了Rep和Cap基因向Rep和Cap蛋白的转录和翻译。
AAV血清型、受体和天然嗜性:
迄今为止,共有12种AAV血清型被描述和报告。所有已知血清型均可感染多种组织类型的细胞。组织特异性由AAV载体的衣壳血清型和假分型决定,以改变其向性范围可能对其在治疗中的应用很重要。
-血清型2
到目前为止,血清型2(AAV2)是最广泛的检查。AAV2向骨骼肌,神经元,血管平滑肌细胞和肝细胞展示了天然矫直主义。
AAV2有三种细胞受体:硫酸乙酰肝素蛋白多糖(HSPG)、aVβ5整合素和成纤维细胞生长因子受体1(FGFR-1)。第一种作为初级受体发挥作用,而后两种具有辅受体活性,使AAV能够通过受体介导的内吞作用进入细胞。HSPG作为主要受体发挥作用,尽管其在细胞外基质中的丰度可以清除AAV颗粒并损害感染效率(图4)。
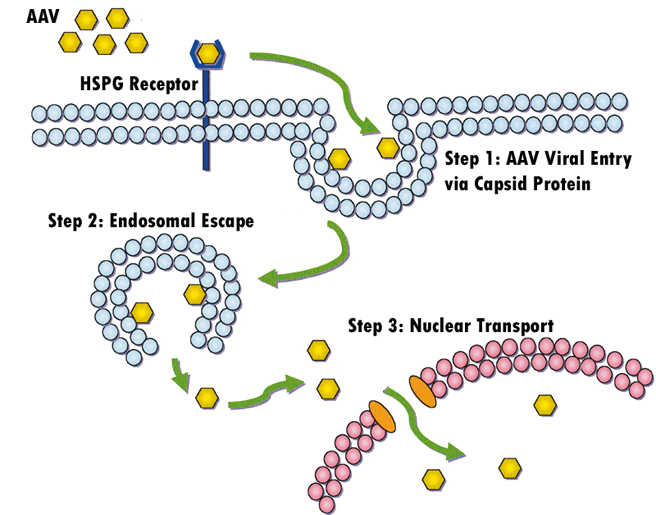
无花果第四章。这幅漫画展示了AAV如何通过结合HSPG受体感染靶细胞。
-其他血清型
虽然AAV2是各种以AAV2为基础的研究中最流行和研究最多的血清型,但已经表明其他血清型作为基因传递载体可能更有效。例如,AAV6在感染气道上皮细胞方面表现得更好,AAV7在小鼠骨骼肌细胞中表现出很高的转导率(类似于AAV1和AAV5), AAV8在转导肝细胞方面表现出色,AAV1和5在向血管内皮细胞传递基因方面表现得非常有效。AAV6是AAV1和AAV2的杂交产物,其免疫原性也低于AAV2。血清型可以根据它们所结合的受体而有所不同。例如,AAV4和AAV5的转导可以被可溶性唾液酸(每种血清型的唾液酸形式不同)抑制,而且AAV5通过血小板来源的生长因子受体进入细胞(表1)。
表1. aav血清型和他们的矫直。
血清型 |
中枢神经系统/视网膜 |
心 |
肺 |
肝脏 |
骨骼肌 |
AAV1 |
十、 |
十、 |
十、 |
|
十、 |
AAV2 |
十、 |
|
|
十、 |
十、 |
AAV3 |
十、 |
十、 |
|
十、 |
|
AAV4 |
十、 |
十、 |
|
|
|
AAV5 |
十、 |
|
十、 |
|
|
AAV6 |
|
十、 |
十、 |
十、 |
十、 |
AAV7 |
十、 |
|
|
十、 |
十、 |
AAV8 |
十、 |
|
|
十、 |
十、 |
AAV9 |
十、 |
十、 |
十、 |
十、 |
十、 |
AAV10 |
十、 |
|
十、 |
|
|
AAV免疫学
AAV对基因治疗师特别感兴趣,因为它在人类中诱导免疫反应的能力明显有限,这一因素应积极影响载体转导效率,同时降低任何免疫相关病理的风险。对AAV载体的先天免疫反应已在动物模型中得到描述。小鼠静脉注射会导致促炎细胞因子的短暂产生,中性粒细胞和其他白细胞会渗透到肝脏中。
-细胞介导
细胞介导的对病毒和载体的反应缺乏特征性,直到2005年,在文献中基本上被忽略。使用基于AAV2的载体治疗血友病B的临床试验似乎表明,可能正在发生靶向破坏转导细胞的情况。结合显示CD8+T细胞在体外可识别AAV衣壳成分的数据,似乎可能存在对AAV载体的细胞毒性T淋巴细胞反应。细胞毒性反应意味着CD4+T辅助细胞参与对AAV的反应,来自人类研究的体外数据表明,该病毒确实可能诱导包括Th1和Th2记忆反应在内的此类反应。在AAV衣壳蛋白VP1中已鉴定出许多候选T细胞刺激表位,如果将该病毒用作基因治疗的载体,这些表位可能是衣壳修饰的有吸引力的靶位。
重组AAV(rAAV)是如何包装的?
与野生型AAV不同,重组AAV(rAAV)无法将其基因组整合到宿主细胞中。随着新开发的rAAV包装技术的发展,如今的rAAV包装不再依赖于辅助病毒(如腺病毒或疱疹)的存在。相反,通过使用无辅助系统,rAAV可以通过将rAAV顺式质粒与Rep/Cap质粒和辅助质粒共转染到包装细胞中来轻松包装。辅助质粒将通过在rAAV包装期间提供腺病毒E1、E2、E4和VA RNA模拟辅助病毒。然后在包装细胞中产生rAAV,并可在共转染后2至3天通过3次冷冻/解冻循环溶解包装细胞收获rAAV。然后通过超速离心纯化释放到上清液中的RAAV(图5)。
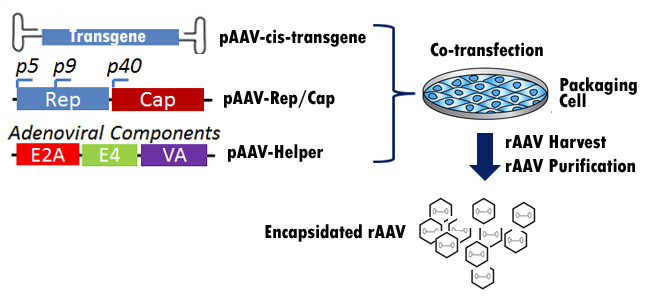
图5。这幅漫画展示了rAAV是如何与无助手系统打包在一起的。
AAV生命周期:
野生型AAV在腺病毒共感染的情况下进行生产性感染。其特点是基因组复制、病毒基因表达和病毒粒子产生。在没有腺病毒的情况下,AAV可以通过整合到19号染色体(AAVS1)来建立潜伏期。腺病毒重叠感染后,潜伏的AAV基因组可以被拯救和复制。AAV生命周期的两个阶段都受到AAV基因组与AAV、腺病毒和宿主蛋白之间复杂相互作用的调节(图6)。
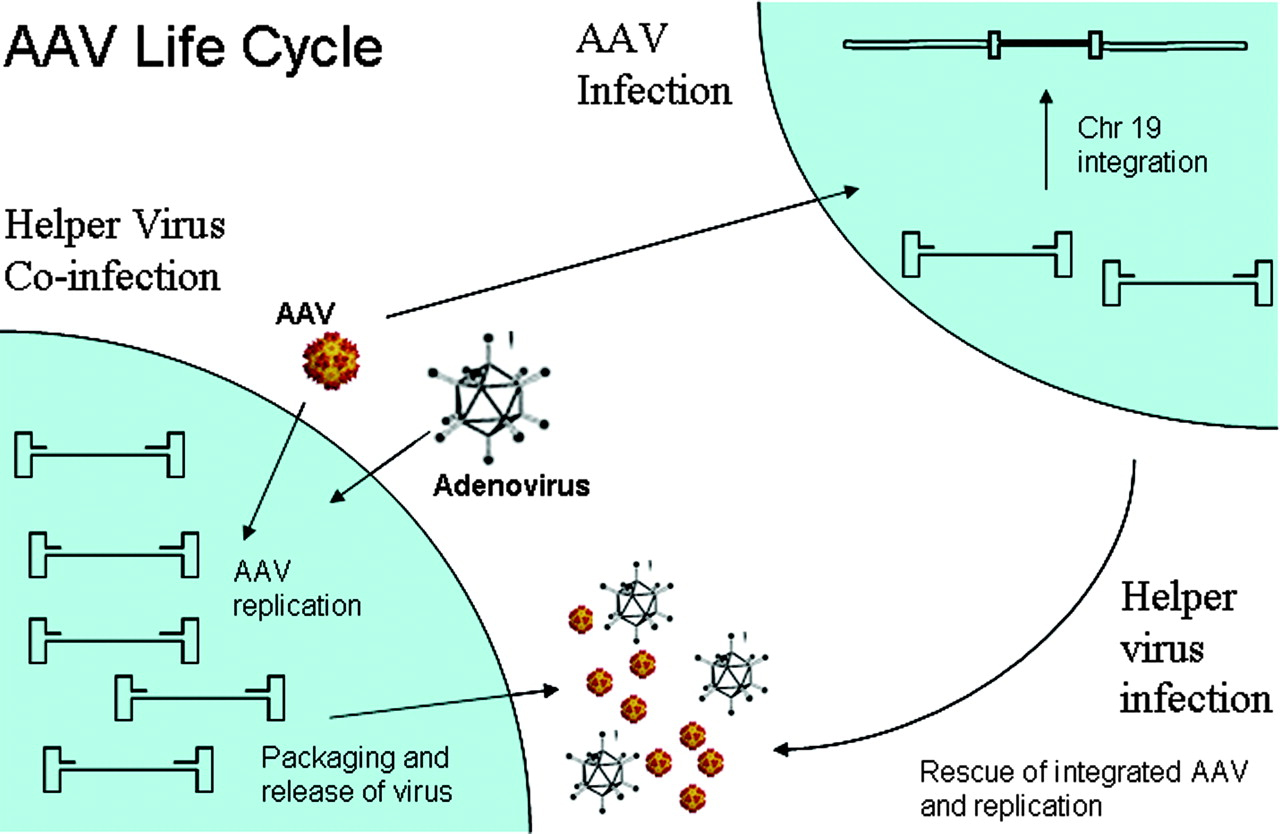
图6。显示AAV生命周期的卡通。
rAAV载体的临床试验:
迄今为止,AAV载体已用于治疗囊性纤维化的一期和二期临床试验,以及血友病的一期试验。帕金森病I期临床试验取得了令人振奋的结果,显示AAV2载体在中枢神经系统中具有良好的耐受性。其他关于AAV治疗卡纳万病、肌肉营养不良和晚期婴儿神经元蜡样脂褐质病安全性的试验已经开始(表2)。
表2。使用AAV载体选择临床试验
我ndication. |
基因 |
管理途径 |
阶段 |
受试者编号 |
地位 |
囊性纤维化
|
CFTR |
肺,通过气溶胶 |
我 |
12 |
完成 |
CFTR |
肺,通过气溶胶 |
二、 |
38 |
完成 |
CFTR |
肺,通过气溶胶 |
二、 |
100. |
完成 |
血友病B
|
使固定 |
肌肉内的 |
我 |
9 |
完成 |
使固定 |
肝动脉 |
我 |
6. |
结束了 |
关节炎 |
TNFR:足球俱乐部 |
Intraarticular |
我 |
1. |
持续的 |
遗传肺气肿 |
AAT |
肌肉内的 |
我 |
12 |
持续的 |
肌肉萎缩症 |
肉聚糖 |
肌肉内的 |
我 |
10 |
持续的 |
帕金森病 |
GAD65,GAD67 |
颅内 |
我 |
12 |
完成 |
卡纳万 |
AAC |
颅内 |
我 |
21 |
持续的 |
巴蒂的 |
CLN2 |
颅内 |
我 |
10 |
持续的 |
阿尔茨海默氏症 |
神经生长因子 |
颅内 |
我 |
6. |
持续的 |
前列腺癌的治疗试验已进入第三阶段,但这些体外研究不涉及对患者直接给予AAV。






